欧宝体育app
一、 斯丹赛成功完成与FDA的Pre-IND会议
近日,上海斯丹赛生物技术有限公司(以下简称“斯丹赛”)成功完成与美国食品和药物管理局(FDA)的Pre-IND会议。会议主要内容是斯丹赛计划在美国I����ND下开展CAR-T候选产品ICTCAR014临床试验,该临床试验的主要候选产品将用于治疗非霍奇金淋巴瘤。会议上,FDA就该计划给出了积极的反馈意见。
斯丹赛董事长、CEO,肖磊博士
针对这一反馈,斯丹赛董事长、CEO,肖磊博���������士表示,“我们在Pre-IND会议上收到FDA的积极反馈令人鼓舞,这与我们2019年第二季度向FDA提交ICTCAR014的IND的计划是一致的。我们非常感谢FDA的支持和指导,因为我们的目标是为最需要的癌症患者带来新的和有针对性的免疫疗法。”
“FDA支持我们在美������国临床研究的详细计划,并就我们提出的质量保证和可比性实验提供了有益的反馈,”前FDA专家,现任斯丹赛高级副总裁兼监管事务负责人Victor Lu说。“我们遵循这些建议,而且正在确保我们符合FDA为基因修饰细胞�������产品制品的监管标准。根据FDA反馈的意见,我们已经制定了清楚详细的计划,并按照我们最初的时间表来推进IND申请流程。“
为了促进ICTCAR014在美国的临床发展,斯丹赛近日在美国马里兰州设立了一个新的总部。同时,还与一家美国CDMO展开合作,为全美各地进行的临床试验来生产CAR-T细������胞产品。为保证三期临床试验和BLA的顺利推进,斯丹赛也在为CAR-T技术�����在美国的商业制造能力奠定了坚实的基础。
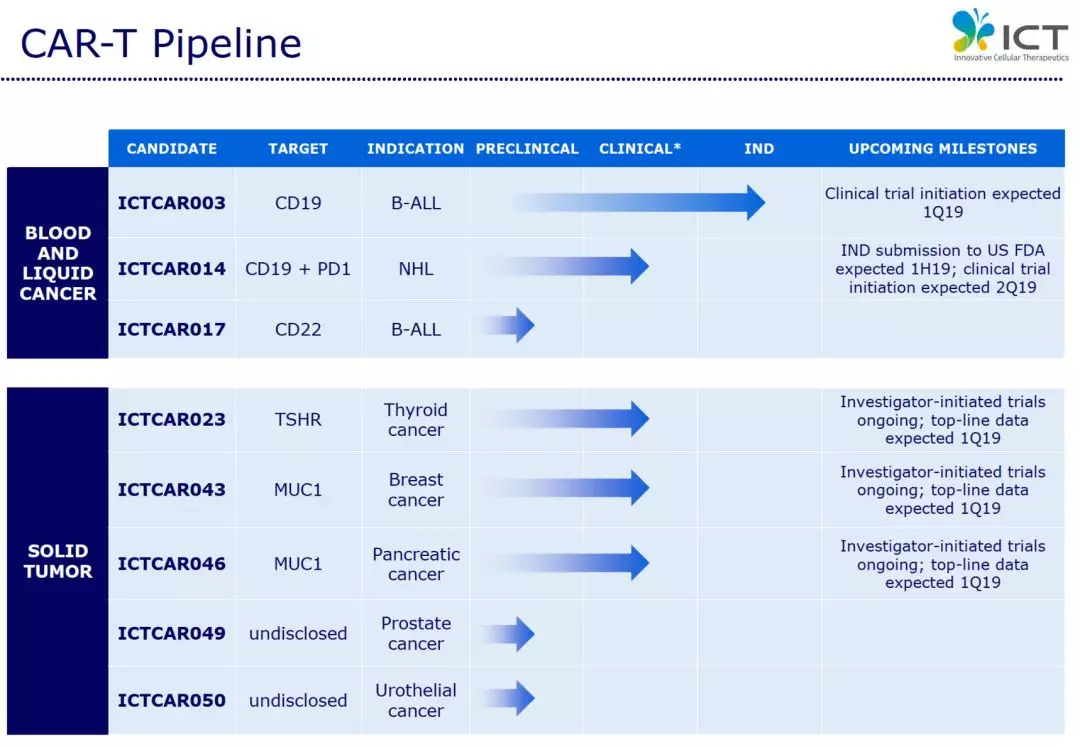
ICTCA����R014是斯丹赛的主导项目之一,是一种靶标CD19和PD1 的新型“装甲CAR”治疗方�����案。目前,正在美国进行非霍奇金淋巴瘤的临床前研究,研究表明PD1的抑制可能增强CAR-T细胞功能。
二、斯丹赛,中国骄傲
�������斯丹赛于2009年在张江示范区核心园成立,成立以来,一直致力于成为全球细胞治疗领航者,致力于开发用于治疗癌症的细胞免疫疗法。
在细胞治疗、干细胞和基因编辑等领域,斯丹赛已达到了国际�������领先水平,申请了26项欧美专利和5项PCT专利,目前在CAR-T细胞治疗�����领域中已走在行业前沿。
 2017年在美国波士顿举行的CAR-TCR峰会,斯丹赛向全球细胞治疗同行汇报了以CD19为靶点的C������AR-T疗法(ICTCAR003)针对急性B淋巴细胞性白血病(B-ALL)以及非霍�����奇金淋巴瘤(NHL)的临床数据。
其中ICTCAR003治疗B-ALL的CR为79.5%,ORR����为87.2%。针对NHL患者的临床试验数据表明,超过50%的晚期淋巴瘤患者能够达到完全缓解。
������斯丹赛是一家拥有临床试验经验的生物技术公司,斯丹赛通过新型CAR-T产品,在晚期白血病和淋巴瘤的临床前和临床治疗中取得了非常有希望的效果。
斯丹赛在美国的主要CAR-T产品, ICTCAR014,是靶向CD19和PD1, 用于治疗非霍�������奇金淋巴瘤。斯丹赛在中国的主要CAR-T产品,ICTCAR003,是靶向CD19作为治疗B细胞急性淋巴细胞白血病的靶点,目前已经获得国内IND临床试验批件。同时斯丹赛还拥有多种主要针对其它血液、液体癌和实体肿瘤的CAR-������T产品。
这些进展已经使斯丹赛在国内CAR-T领域处于龙������头地位,推动中国CAR-T领域的发展�����处在与美国“并跑”的状态。
部分内容参考原文:
//www.globenewswire.com/news-release/2019/03/19/17��������56976/0/en/Innovative-Cellular-Therapeutics-Announces-Successful-Completion-of-Pre-IND-Meeting-With-FDA.html
2017年在美国波士顿举行的CAR-TCR峰会,斯丹赛向全球细胞治疗同行汇报了以CD19为靶点的C������AR-T疗法(ICTCAR003)针对急性B淋巴细胞性白血病(B-ALL)以及非霍�����奇金淋巴瘤(NHL)的临床数据。
其中ICTCAR003治疗B-ALL的CR为79.5%,ORR����为87.2%。针对NHL患者的临床试验数据表明,超过50%的晚期淋巴瘤患者能够达到完全缓解。
������斯丹赛是一家拥有临床试验经验的生物技术公司,斯丹赛通过新型CAR-T产品,在晚期白血病和淋巴瘤的临床前和临床治疗中取得了非常有希望的效果。
斯丹赛在美国的主要CAR-T产品, ICTCAR014,是靶向CD19和PD1, 用于治疗非霍�������奇金淋巴瘤。斯丹赛在中国的主要CAR-T产品,ICTCAR003,是靶向CD19作为治疗B细胞急性淋巴细胞白血病的靶点,目前已经获得国内IND临床试验批件。同时斯丹赛还拥有多种主要针对其它血液、液体癌和实体肿瘤的CAR-������T产品。
这些进展已经使斯丹赛在国内CAR-T领域处于龙������头地位,推动中国CAR-T领域的发展�����处在与美国“并跑”的状态。
部分内容参考原文:
//www.globenewswire.com/news-release/2019/03/19/17��������56976/0/en/Innovative-Cellular-Therapeutics-Announces-Successful-Completion-of-Pre-IND-Meeting-With-FDA.html